资讯信息
NEWS
资讯信息
NEWS
文献解读 | Nature Communications 器官芯片助力多囊肾病研究!
2023-07-21
文献解读 | Nature Communications 器官芯片助力多囊肾病研究!
《Glucose absorption drives cystogenesis in a human organoid-on-chip model of polycystic kidney disease》在器官芯片中构建多囊肾病模型,研究葡萄糖吸收驱动的囊胚生成。

多囊肾病(PKD)是最常见的肾遗传性疾病之一,是伴常染色体显性遗传的单基因遗传病,主要表现为从肾脏和其他器官的导管结构中长出大小不一的囊肿,囊内充满液体,随着病情发展,脏器增大、变形,最终危及生命。PKD的机制难以在体内破译,小鼠模型不具有人类疾病的完全表型或基因拷贝,虽然在人肾类器官中可以以遗传特异性的方式重建PKD的膀胱发生,但膀胱发生的潜在机制仍不清楚。
来自华盛顿大学的Sienna R. Li构建了一款PKD芯片(PKD-on-a-chip)微生理系统,在充满流体剪切力的微环境中培养类器官,通过吸收而不是分泌途径,促进肿瘤生长。有趣的是,他们发现血流有诱发PKD囊肿的作用,囊肿在血流介导的扩张中吸收葡萄糖,这个过程可以被药物阻断。类器官囊肿在发生过程中向外极化。通过小鼠验证了葡萄糖通过囊肿输入肾间质的过程,并且肾间质可从小管中分离和扩张。
相关研究成果以“Glucose absorption drives cystogenesis in a human organoid-on-chip model of polycystic kidney disease”为题于2022年12月23日发表于《Nature Communications》上。
1、血流诱发PKD类器官囊肿
首先通过静态贴壁培养敲除PKD1或 PKD2基因的hPSC,形成类器官。在分化的第18天,将类器官转移至悬浮培养物中,大多数大多数PKD1-/-或 PKD2-/-类器官在1-2周内形成囊肿(图1a),PKD类器官和对照组之间的差异可量化,并且非常显著。这表明,PKD类器官以基因特异性的方形成囊肿。
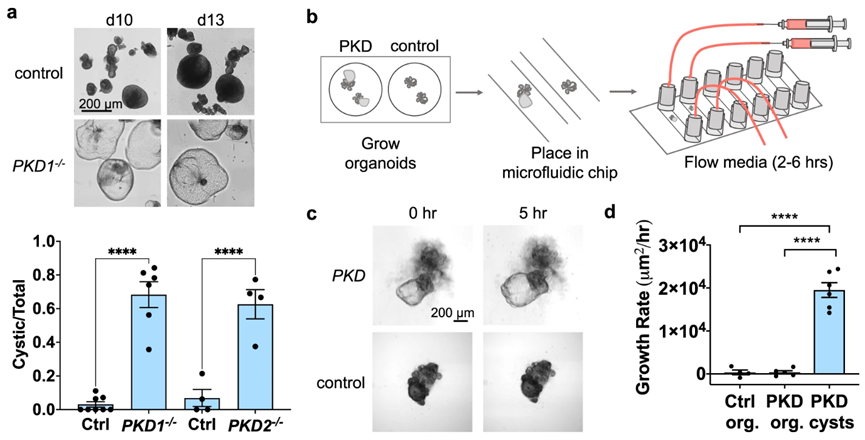
图1:类器官PKD囊肿在流体作用下生长
作者设计了一种微流体系统,该系统允许对肾脏类器官进行实时成像(图1b)。hPSC分化成类器官后转移至芯片培养。用与体内肾小管生理剪切力近似的剪切应力(0.2 dynes/cm2)培养PKD和同基因对照类器官。作者观察到PKD类器官的囊肿在流动下迅速生长(面积变化约20000μm2/hr,或直径变化约160μm/hr),而PKD的非囊性区域和缺乏PKD突变的同基因对照类器官无明显变化(图1c,d)。
2、扩散可以部分替代流动
在实验过程中,作者发现有的染料未能进入微流体室(图2.a)。为了保持对照组的合理性,作者对比了不同培养基体积对囊肿生长速度的影响,发现在1mL培养基中,囊肿的生长速度约3000μm2/hr,而含在25mL培养基中增加到约10000μm2/hr(大约是流体条件下的一半,图2b,c)。作者还探讨了压力对囊肿的影响。将类器官悬浮在500μl或10mL培养基中,并确保高度恒定为1cm进行培养(图2d)。结果发现,压力对囊肿的影响小于体积(图2e,f)。
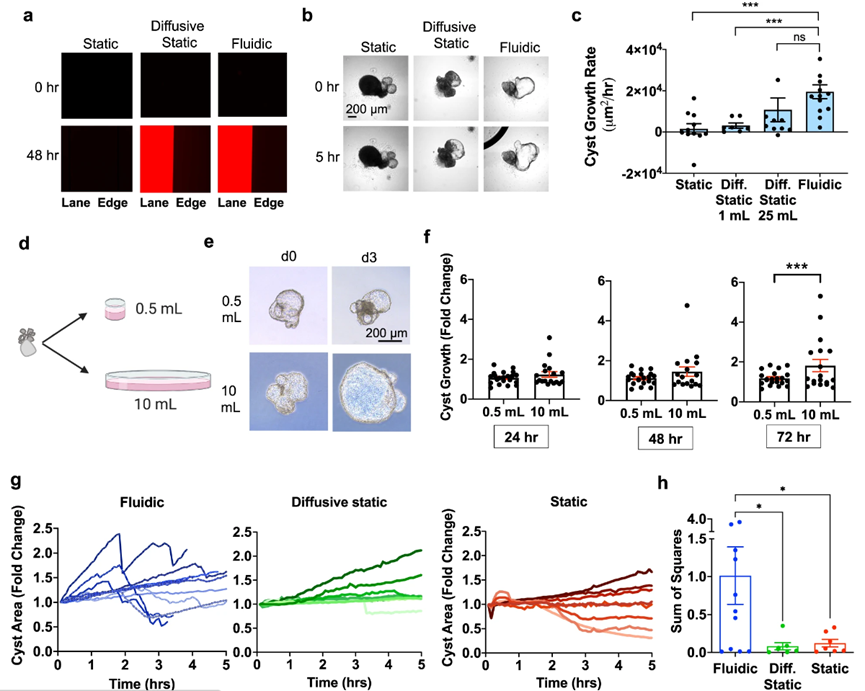
图2:静态扩散可以部分替代动态血流
在流体环境下,PKD囊肿表现出波动的生长曲线,在周期性“呼吸样”运动中扩大和收缩(图2g)。生长和收缩出现在血流开始后数小时内,并且这种震荡行为是流体条件下独有的。与任何静态条件相比,流体条件下的囊肿动力学都要(单个结构内的大小随时间的变化)要大得多(图2h)。
3、囊肿在血流介导的扩张中吸收葡萄糖
通过延时成像观察NBD葡萄糖的扩散情况,在空载芯片内,扩散静态条件和流体条件下,荧光逐渐增加并稳定在相似的水平,而在非扩散静态条件下在通道内没有可检测到荧光的积累(图3a)
在培养类器官时,PKD囊肿在流体和扩散静态条件下吸收葡萄糖的量没有显著差异(图3b,c)。对类器官小管中葡萄糖吸收随时间变化分析证实,静态条件下的培养基体积是营养吸收的关键因素(图3d)。在静态扩散条件下,类器官对葡萄糖的吸收近似于S形,而流体条件下近似于指数曲线,两种条件在葡萄糖吸收的最大水平上趋于稳定(图3e)。这表明,与呈现等效总葡萄糖暴露的静态对照相比,流动对类器官中的葡萄糖吸收没有额外的影响。
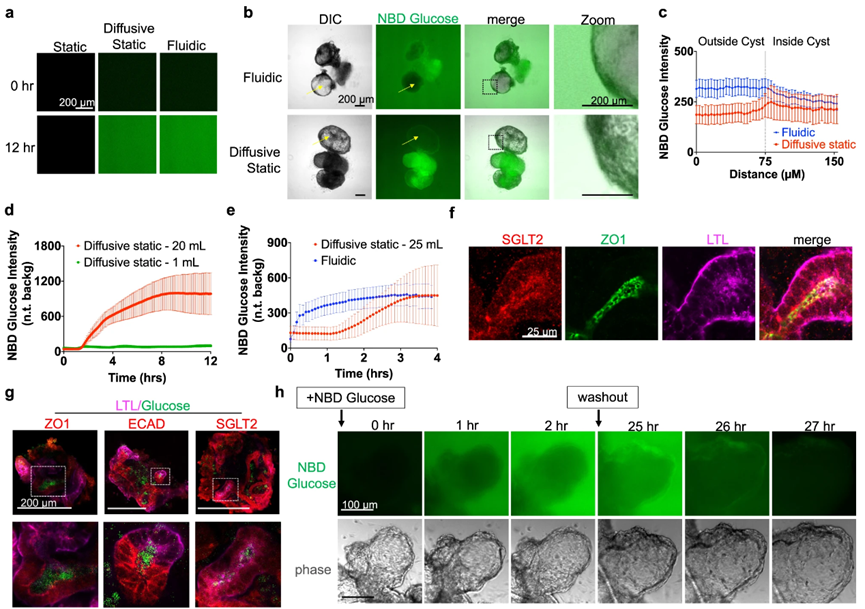
图3:PKD类器官在流体和静态条件下的葡萄糖吸收
葡萄糖吸收是肾脏类器官的一般特性。在非囊性结构中,钠-葡萄糖转运蛋白-2(SGLT2)在类器官小管中表达并在顶端表面富集(图3f)。免疫荧光证实,NBD葡萄糖被吸收并积聚在类器官近端和远端小管内(图3g)。当负载NBD葡萄糖的PKD类器官切换到仅含有未标记葡萄糖的培养基中(洗脱)时,NBD葡萄糖从这些结构中迅速消失(图3h)。因此,类器官以动态方式连续积累和释放葡萄糖。
4、抑制葡糖糖转运阻止囊肿生长
在动物模型中,葡萄糖转运抑制剂被认为对PKD既有积极作用也有消极的作用。为了在功能上测试囊肿生长是否与人类器官中的葡萄糖转运有关,在静态条件下通过增加D-葡萄糖浓度量化囊肿扩张。在15-30mM葡萄糖时生长最大,囊肿扩张约50%(图4a,b)。
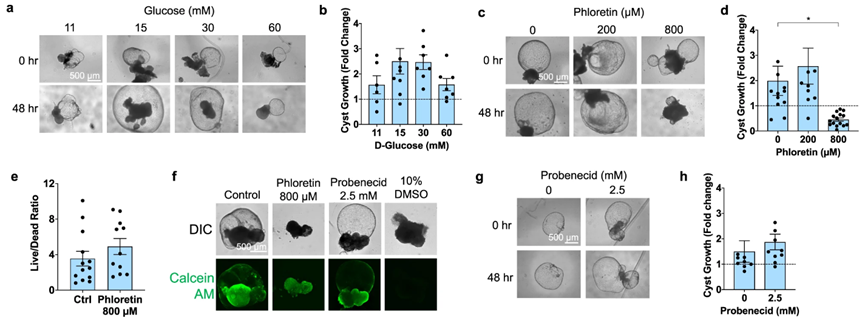
图4:PKD囊肿响应葡萄糖刺激而扩张
以上实验表明抑制葡萄糖输入可能使输出机制占主导地位,导致由于渗透作用而阻断甚至逆转囊肿生长。为了验证这一假设,作者使用根皮素(一种广谱的葡萄糖摄取抑制剂)在15mM葡萄糖中进行测试,发现在77μM的浓度下可将囊肿大小减小800%(图4c,d)。根皮素处理24和48小时活死染色显示无明显毒性(图4d,e)。与SGLT抑制剂相比,丙磺舒是基底外侧膜上OAT1转运蛋白的抑制剂,与无毒剂量的对照组相比,对囊肿生长没有影响(图4f-h)。总体而言,这些发现支持了葡萄糖摄取的药理学抑制剂能够阻止PKD类器官模型中囊肿扩张的假设。
5、类器官囊肿向外极化
如图5a所示,PKD囊肿呈倒极化,顶端纤毛表面朝外朝向介质并暴露于流动中(图5b)。并且,在囊肿衬里上皮内部含有一层表达α平滑肌肌动蛋白的细胞,其形成富含层粘连蛋白的基底膜,相反,在人肾组织中,基底膜和肌成纤维细胞样细胞在外部包围囊肿(图5c)。在这两个系统中,顶端细胞极性与基底膜相反。然而,当类器官中的PKD囊肿被胶原蛋白覆盖时,囊肿极性保持倒置,并且没有重新极化,纤毛表面背对细胞外基质,表明类器官囊肿极性根深蒂固(图5d)。
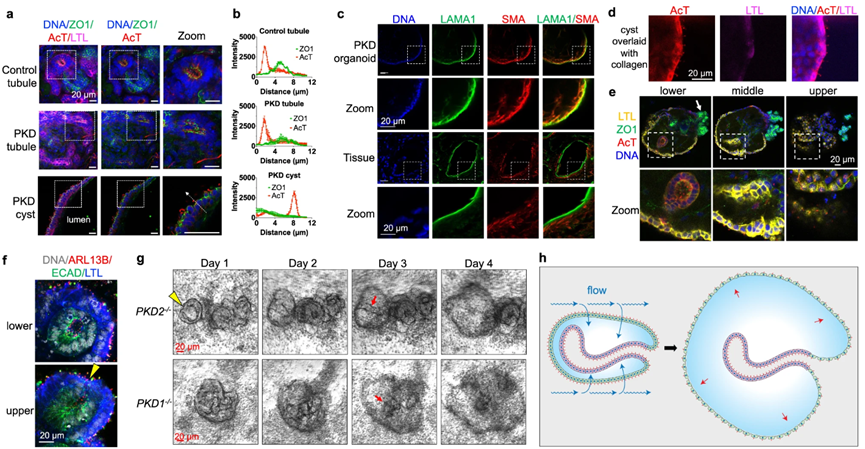
图5:PKD囊肿通过向外上皮的扩张形成
年轻的囊肿由上皮球状体结构组成,具有向下的肾小管折叠,朝内(图5e)。而类器官内部的“小管”是该外周上皮的内陷,这些内陷小管的最内侧区域富集了ECAD(远端小管的标志物),而外周上皮富集了LTL(图5f)。因此,类器官构成了连续的近端至远端上皮,顶端表面在外周(更近端)上皮上向外极化,在结构的内部(更远端)上皮向内极化。
囊肿始终如一地在类器官的外围形成,在囊胚形成的早期阶段,囊肿内部的肾小管结构在扩张时仍然可见(图5g)因此囊肿是由面向介质的类器官的外周上皮形成的,而不是从倾向于保持锚定的内部管状内陷形成的(图5h)。这与外周上皮介导的吸收机制一致。
6、吸收性囊肿在体内形成
前面提出了体内囊肿形成的可能模型(图6a):肾小管上皮的顶表面吸收葡萄糖,然后通过细胞旁或跨细胞途径沿渗透梯度吸收葡萄糖,以保持上皮两侧的平衡浓度。这种吸收活动缺乏适当的出口,这些小管发生变形和膨胀以填充产生的间质空间。随着囊肿的生长,这一过程会持续,并且可能因相关肾小管周围毛细血管的逐渐丧失或脱离(减少吸收下沉)以及间质间充质基质细胞的生长而加剧,间质间充质基质细胞提供支架并合成细胞外基质以适应扩张的上皮。
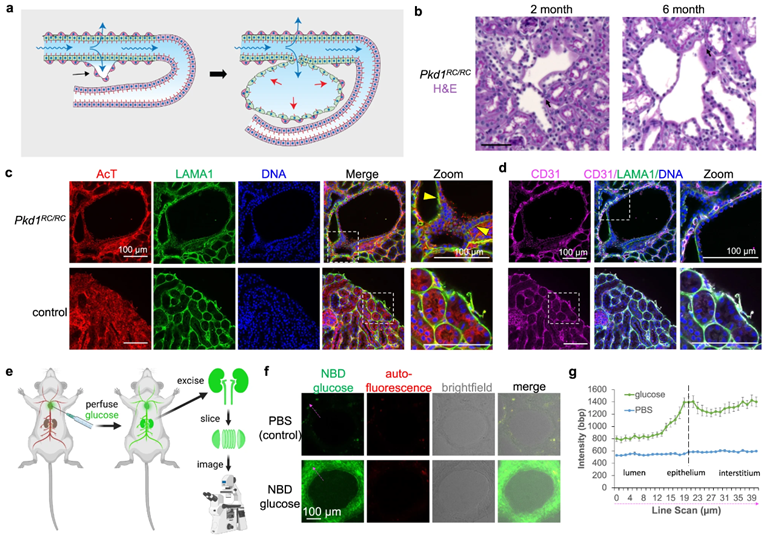
图6:PKD囊肿在体内吸收葡萄糖
2个月大小鼠组织的组织学切片和共聚焦图像显示小管和微囊肿之间有连续的基底膜,这与微囊肿从管状袋中形成的可能性一致,这些管状袋子仍然能够通过邻近小管的壁吸收(图6b,c)。虽然这些微囊肿中的大多数仍然与肾小管周围毛细血管紧密相关,表明它们继续重吸收,但部分上皮似乎已与内皮分离,导致液体积聚或间质扩张的区域(图6b-d)。
通过向小鼠注射NBD葡萄糖并立即取回肾脏的方法(图6e),荧光显示囊肿衬里上皮和周围的间质容易吸收NBD葡萄糖(图6f-g)。因此,囊肿在体内保持吸收,PKD肾脏作为一个整体容易积累葡萄糖。
总而言之,根据特定模型的结构和功能特征,将类器官与受控的微流体微环境耦合构建的器官芯片装置,是一种有发展前景的体外疾病建模方法。