资讯信息
NEWS
资讯信息
NEWS
综述解读|复杂体外模型(CIVMs)在药物开发的安全性测试和疾病模型中的应用(下)
2023-01-17

5、多器官芯片模型
5.1 多器官芯片类型描述
多器官芯片(MOOC)主要分为静态、半静态、级联和直联四大类。静态MOOC是多个器官/组织容纳在同一个微流体装置中。器官间通过一条特定流体连接起来,使用通用培养基,培养大于14天。由于既定的程序及较低的灵活性,对不同组织的适应性较差。静态MOOC通常基于PBPK/PD建模,生物分析可以通过集成到平台中的传感器进行,但由于组织不能解耦,因此验证/确认系统存在一些困难。
半静态MOOC包括暴露在流体流动中的组织,或通过下层集成微流体通道和Transwell培养形成的组织。单个组织在整合前可根据其具体需要进行预培养,可培养大于14天。它具有很高的灵活性,可以选择混合或和不同的组织组合。该模型对合并不同的组织类型具有很高的适应性。该系统可以实现生理建模和PBPK/PD建模。通过传感器进行生物分析可以集成到平台中。组织在合并前可以进行验证/鉴定,但一旦连接多个组织,挑战性增高。
级联的MOOC为单个的单器官芯片,通过微连接器或管道连接在一起。它们提供了一个更精确的人体模型,并将疾病器官模型纳入其中。可以培养大于14天。它具有很高的灵活性和高度的适应性。主要的缺点是没有标准化的平台。
直联MOOC类似于级联的MOOC,在级联MOOC中,单个MPS是单独培养的,但不同于级联MOOC那样连接,在直联MOOC中,器官相互作用是通过类似于体内一个MOOC到下一个MOOC的连续培养实现的。这增加了灵活性、适应性,以及分别验证/确认每个MPS的能力。这些系统已被用于PK和毒性研究。
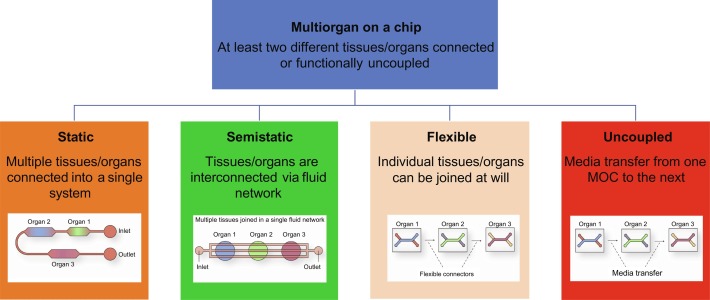
5.2 与药物发现相关的MOOC示例
与单器官芯片相比,MOOC增加价值的关键点是更好地理解器官间对给药的反应,并能更好地评估治疗指标或PK/PD药物关系。MOOC应该有能力单独对不同的外部刺激做出反应,再现人体的器官功能。当开发相互连接的器官芯片时,应该从使用角度出发。多器官系统应该使用合理的组织或器官组合来复现相关的生理学或病理学现象。在确定要连接在一起的MPS数量时,应该考虑有足够的生物功能,使其易于使用,并限制MPS成本。
5.2.1 安全性和毒性
与药物开发相关的MOOC的主要开发领域是安全性/毒性和ADME领域。通过引入细胞和物质的组合,MOOC可以用于毒性测试,生成的结果可以帮助提高药代动力学模型预测未知机制或现象的精度。早在2004年,Shuler博士开创了该领域的先河,他引入了第一批MOOC平台之一,将基于细胞系的肺、肝脏和脂肪体外模型连接起来,以研究药物的生物分布。从那时起,有一些值得注意的研究显示了双器官MPS系统的价值,其中肝脏是所有系统的共同器官。在药物代谢研究中,肠肝相互连接的代谢模型已经在许多不同的MPS配置中得到了例证。例如,Tsamandouras等人通过半静态MOOC演示了肝肠模型在体外探索药物PK特性方面的效用,研究了双氯芬酸和氢化可的松两种化合物的动力学。这使得我们有能力确定肝脏和肠道之间是否存在交叉信号,并使用机理建模来通过MPS中的PK过程推导内在参数(例如渗透性)。这些计算数据可以用来更好地预测某种化合物的性质。该模型的局限性在于肠道腔室由Caco-2/HT29-MTX细胞组成,而不是原代肠细胞,不能完全模拟体内肠组织的代谢功能,然而,肝部分是通过肝细胞接种入支架,附着并形成三维结构。该平台还需要进一步验证,因为在该系统中只评估了两种化合物。
第二个例子是一个半静态MOOC,该MOOC具有微流体通道,通过血管化来研究一个双器官系统,该系统要么是肝脏(带有HepRG和人星状细胞的三维肝脏球)-肠(原代拟柱状三维上皮屏障层),通过口服给药,要么是肝脏-皮肤(皮肤活检组织屏障),使用半静态方法系统给药[174]。两种MOOCs均利用肝脏微球,使用HepRG细胞,而非原代肝细胞,其功能和代谢活性与原代肝细胞不同。双器官系统能够承受重复剂量的曲格列酮暴露。在这两种情况下,肝脏对各自的曲格列酮刺激反应正常,从mRNA和免疫组化水平上都证明了这一点。对于肝-肠模型,数据显示曲格列酮通过肠屏障并泵入肝组织进行代谢的。该平台还需要进一步验证,以便更好地理解该模型的局限性。
另一项使用半静态MOOC系统的研究表明,胰岛和肝脏聚集体结合在微流控芯片系统中,肝脏和分泌胰岛素的胰岛组织之间存在功能性反馈环。这项研究通过生成替代功能糖耐量试验来复现标准的静脉糖耐量试验,在该试验中,肝脏与胰岛相连,胰岛微组织响应葡萄糖负荷释放的胰岛素累积量通过检测培养基获得。肝脏-胰腺MOOC显示了调节葡萄糖消耗的能力,并反映了人体葡萄糖稳态。该研究证明了双器官系统在阐明胰岛和肝脏之间交叉效应的重要性。
还有一个两个器官之间的交叉效应的例子是一个级联MOOC,它显示了肝-肾模型在研究药物或环境毒理学影响方面的价值。该双器官MOOC表明,已知的肾毒素和人类致癌物马兜铃酸I (AA-I)只有在肝脏和肾脏相互连接时才具有毒性,这在肾脏MPS中未观察到。
最近有一些三至五个器官系统的例子,用于评估毒性。例如,一篇使用级联MOOC平台的论文展示了一个互联的三组织系统,其中生物打印的肝脏和心脏类器官通过在气液培养的肺类器官连接。复杂的综合反应只有在器官相互连接时才能观察到。Uwe Marx博士和他的同事开发并表征了一种连接肝脏、肠道、皮肤和肾脏的半静态四器官芯片-“ADME”,这是首次尝试建立一种体外微流体ADME分析系统。四器官“ADME”- MOOC系统包含两个独立的内置泵,一个模拟血液循环,另一个模拟尿液形成(功能是通过肾脏排出分泌物)。经过28天,肝脏、肠道和肾脏细胞显示出12个关键基因的稳定表达,这些基因涉及肠道吸收,肾脏再吸收、分泌和屏障完整性,肝功能和代谢,每个液体腔室很好地保持着特定的葡萄糖浓度。这是MOOC发展的一个重要里程碑,因为它展示了一个微流体系统中所有四个器官的功能活动,该系统由三个不同的流体分别运行,模拟了营养物质和废物是如何被身体吸收和分泌的。
另一项研究不是将组织连接在一起来研究,而是五种人类MPS模型(肠、肝脏、肾脏、骨骼肌和神经血管模型)进行功能耦合,其中相互作用是通过类似体内的连续的,器官到器官的培养基转移。在该系统中测试了三种化合物(特非那定、三甲胺和维生素D3),对比这些化合物已知的体内代谢和转运显示与临床数据一致。本研究不仅证明了单一OOC在药物试验中的可行性,而且强调了连接不同器官(通过功能耦合)模拟我们体内药物代谢的重要性。
与二维模型相比,MOOC模型在再现器官水平功能和延长体外培养时间方面有很大的改进。特别是,类体内组织的微结构,复杂的生化环境,动态机械行为都是模拟微环境的重要因素,以此为指引,实验者在设置浓度梯度和模仿肝功能以模拟微环境上取得了重要进展。然而,这些平台要在药物开发过程中得到更广泛的利用和接受,还需要克服许多障碍。例如,芯片设计的高度可变性,细胞来源选择的缺乏,有限的芯片材料,芯片制造技术问题(例如,生物传感器集成和光学兼容性),自动化复杂性,以及与成本相关的问题。
5.2.2 PK-PD与疗效
在肿瘤学领域,专注于PK-PD和疾病建模的多器官芯片实例越来越多。一个利用MOOC(肝-肿瘤)进行药物开发的例子是体外模拟木犀草素的代谢、分布(PK)和肿瘤杀伤活性(PD)的PK-PD模型,,并将PK-PD模型应用于肝-肿瘤MOOC系统来解释结果。根据MOOC的流速和腔室大小生成了PK模型的参数。用于建立PD模型的参数是基于微孔板数据的。木犀草素在肝部分中被HepG2细胞代谢后才能对宫颈癌细胞起杀伤作用。评估PK-PD模型,预测的肿瘤细胞生长低于实验数据。
另一种基于多细胞类型的器官芯片用于模拟体外药物吸收和代谢。这是通过共培养Caco-2(肠细胞)、HepG2(肝细胞)和U251(肿瘤细胞)来模拟肠、肝和胶质母细胞瘤来实现的。通过使用更多与人类相关的原代细胞类型而不是细胞系,MOOC可以得到改进。药物CPT-11被用来测定治疗胶质母细胞瘤的药物吸收、代谢和毒性。研究表明CPT-1可以通过肠细胞,被肝细胞代谢成SN-38,人NHOU杀死肿瘤细胞。这种单微流控芯片可以通过排列来支持可能的高通量药物吸收、代谢和疗效筛选[183]。另一种用于PK-PD的MOOC平台,采用了悬滴法生成的微组织,并允许通过微流体通道连接微组织,以实现恒定的培养基灌注或化合物剂量[147]。最后,肿瘤疾病建模,如与两种组织互连的肿瘤转移模型。Skardal等人证明了这一点,他们可以观察到荧光标记的结肠癌细胞通过微流体通道从水凝胶肠道结构迁移到受药物治疗影响的肝脏结构[184]。这些MOOCs可用于临床前开发的后期,对肿瘤化合物进行分类,在进行体内动物模型之前确定其PK-PD数据,但这些模型确实需要进一步的实验,以确定它们在预测一系列化合物的PK-PD方面的准确性/预测性。
未来用于药物发现后期开发的MOOC中先导化合物的测试需要进一步的标准化,小型化,和测试特定患者群体的能力以协助临床设计中病人入组。在药物开发中大规模应用的问题包括MOOCs日益增加的复杂性,缺乏允许定量设计和分析的一致的数学模型。随着微加工和微流控技术的进一步发展,以及美国国立卫生研究院(NIH)和国防高级研究计划局(DARPA)资助的研究增加,单器官芯片或MPS的概念不断发展,多器官芯片(MOOC)或人体芯片平台将继续改善整体细胞功能,更好地了解药物暴露后组织之间的相互作用,从而更好地进行体外预测药物对人体的作用。
6、结论
尽管最新的复杂体外模型有望为人类病理生理学建模和治疗结果预测提供改变游戏规则的解决方案,但大多数这些技术仍处于起步阶段,存在一些差距。作者认为,患者相关性和预测能力不一定与模型复杂度成正比;事实上,在某些情况下,为了特定的目的,即使是简单的2D体外系统也可以很好地满足某些实验目的。因此,除了总体上适用于大多数复杂体外模型的高级方面外,还需要根据具体情况基于确定的预期进行具体评估。最后,作者强调了在临床前和临床研究之间建立一条线,这需要在复杂的体外模型开发中进行临床投入;通过临床前和临床科学家之间的相互作用,确保了特定疾病领域的生物标志物和功能性评估的一致性。