资讯信息
NEWS
资讯信息
NEWS
综述解读|复杂体外模型(CIVMs)在药物开发的安全性测试和疾病模型中的应用(中)
2023-01-16

3、复杂体外皮肤模型
皮肤作为身体的外部器官,具有可及性,加上3R原则以及动物试验在化妆品行业的监管限制(例如,欧盟化妆品指令),促成了从20世纪70年代开始的体外皮肤建模的快速发展。在过去40年中,人类皮肤培养模型已被纳入药物作用机制的发现、药物靶点作用、疾病建模、安全性以及在某些情况下的功效研究过程中。尽管技术进步令人印象深刻,但人类皮肤培养模型在结构和细胞复杂性方面仍然相对简化,在一定程度上限制了其向市场转化的潜力。
角质形成细胞是一种特化的上皮细胞,它能构建、修复和补充人表皮的分层鳞状组织结构。在单培养系统中,角质形成细胞已实现了从2D培养模型,到气液培养3D重建人表皮(RHE)等效物等,各种复杂程度的分化。最近一项从患有单基因皮肤起泡障碍(即大疱性结缔型表皮松解症)的患者身上提取的角化细胞,经过基因修饰后被用于近全身皮肤移植的成功,充分体现了这些技术在药物开发中的力量。虽然RHEs在组织逻辑上与角化、分层的鳞状上皮相似,但仍然缺少关键的皮肤细胞类型(例如,产生色素的黑色素细胞和抗原呈递/抗原感知的朗格汉斯细胞),也无法构建关键的附属结构(即毛囊、皮脂腺和汗腺),因此限制了它们在制药工业中广泛应用。
许多自下而上的方法要么在表皮内用多种细胞建立额外的复杂性,要么将关键的基质元素(即成纤维细胞、血管和神经)合并到真皮层中,在某些情况下,真皮层下还整合了脂肪细胞。一般来说,这些方法依赖于研究者合理获得的体细胞祖细胞,但这些细胞可能并非自体供体,同时体外增殖能力有限,需要专门的ECM成分进行分化。例如,在这些更复杂的模型中,需要考虑成纤维细胞异质性,即使是单个供体的基质细胞也存在差异,这会影响健康皮肤或银屑病等疾病3D模型的分化和生物标志物的表达。三维生物打印正在探索将不同皮肤细胞类型放置在特定的空间位置,以提高保真度并增强皮肤培养模型中的功能参数,如整合干细胞生态位或附属结构。同时,hiPSCs已沿着不同的皮肤谱系(即角质形成细胞、成纤维细胞和黑色素细胞)进行离散分化,以构建更复杂的三维皮肤模型;这些基于ipsc的方法可以进一步用于将免疫细胞整合到完全自体的、具有免疫能力的皮肤病模型的开发中,这将是目前基于细胞因子的角化细胞极化或非自体免疫细胞共培养模型(如牛皮癣)的重大进步。
4、复杂的体外肿瘤学模型
4.1 实体瘤组织微环境(TME)研究背景
传统2D单层培养体系目前未能再现体内实体肿瘤和肿瘤微环境的许多特征。大多数2D和3D肿瘤体系与临床样本缺乏相关性。当前的三维肿瘤模型包括组织切片或外植体、使用支架/微载体或中空纤维的生物反应器、多细胞球体和多层细胞体、基于凝胶/基质的培养体系和细胞3D打印。最广泛使用的三维培养系统是多细胞球体。尽管这些系统具有许多优点,但它们在药物开发过程中的应用仍然是一个挑战,因为它们缺乏实体肿瘤的复杂性。
最新进展通过多种细胞类型(共培养)或患者来源的细胞、ECM材料、可溶性因子和微流体成分的结合,增加了其复杂性。本节将解释关键细胞成分、正在开发的不同微观肿瘤模型,以及肿瘤模型如何应用于药物发现。其中包含四个关键属性,生理相关性,临床可译性和可预测性,稳健性和再现性,以及灵活性。
4.2 微流体平台与肿瘤模型开发
肿瘤细胞系,通常来自转移性或快速生长的肿瘤,但其缺乏遗传多样性并表现出遗传漂移,基因表达更接近于正常组织,药物的可预测性较差。最近建立的使用患者来源的3D类器官培养系统的体系为个性化早期药物筛选工作提供了机会。肿瘤类器官来源于患者肿瘤样本,并显示出与患者的相应活检样本以及培养物中保持的可比体细胞拷贝数改变和常见CRC驱动器突变高度一致。肿瘤类器官已证明药物敏感性与基因组特征相关,以揭示药物反应改变与分子特征相关。最近有一些证据表明,静态培养系统中的类肿瘤器官可以用于低通量(数百种化合物)药物筛选模式,因为它们能产生可重复的高价值药物敏感性数据。肿瘤类器官目前的局限性是可扩展性降低,与细胞系相比增加了成本,潜在丧失了上皮完整性(上皮到实质转变),以及缺乏了基质或血管室。有些限制通过将肿瘤类器官并入包含基本肿瘤微环境的微型平台来克服。目前,使用细胞系和球状体的体外模型都由于其无法保留肿瘤细胞异质性和肿瘤结构而受到限制,导致临床结果预测不佳(图2)
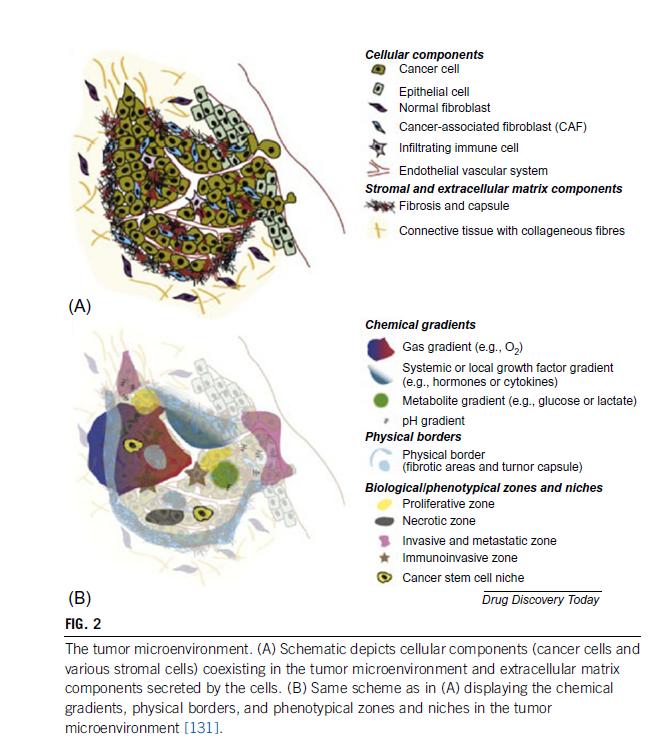
图2
与用于肿瘤药物开发的传统细胞筛选方法不同,微流体平台具有以下优点:通过灌注方法在组织水平上更接近地模拟化疗的生理反应,增强药物暴露以及营养物质和代谢废物的交换。试剂用量减少能通过在非常复杂的单芯片肿瘤装置或在一个装置上集成多个功能单元上提高吞吐量来实现。它还能进一步减少介质、试剂、可溶性因子和化合物体积的潜力。设备中的生物样品到显微镜物镜的距离很短,因此,与成像更大的宏观三维体外模型相比,更容易以高分辨率成像所有细胞。
肿瘤活检和肿瘤切片已在宏观水平上用于进行体外化合物研究,因为与当前的体外肿瘤模型相比,它们能够保存肿瘤结构以及细胞和微环境异质性。最近,使用多孔膜支架或基于基质支架的模型的静态宏观系统在识别药物敏感性和预测临床益处方面取得了成功。然而,由于具有通量低、样品的异质性高、价格昂贵、脆弱细胞快速退化、细胞结构和细胞表型的改变等缺点,这些模型存在局限性(图3)。
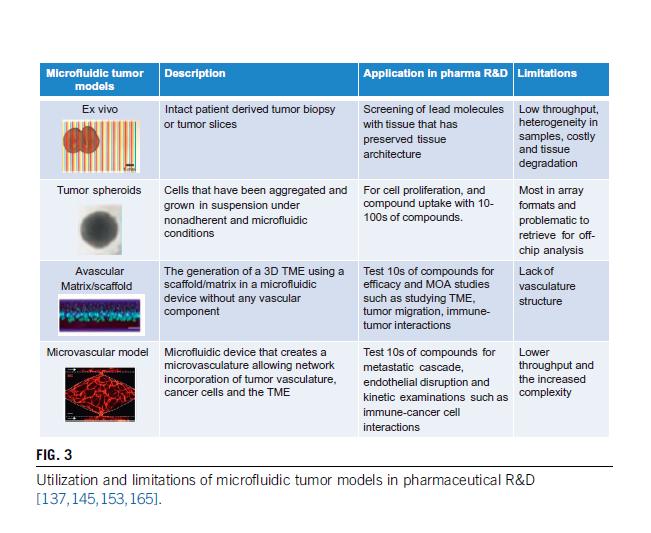
图3
微流体系统是一种可以帮助提高肿瘤活检或切片样品的寿命和完整性的解决方案。微流体模型可以提供持续的营养供应和去除代谢废物,从而创造更稳定的环境。它形成了一种具有流体动力的环境,类似在肿瘤微环境的生理范围内的剪切应力。最近的两个微流体平台证明了将离体肿瘤切片或活检结合到微流体系统中的潜力。Holton等人的论文证明了在10通道连续微流体培养装置中,针吸肿瘤活检的存活时间延长至少5天,并且可以通过显微镜评估药物反应性,而无需使用小分子(盐酸阿霉素)和大分子(EPCAM抗体荧光标记)来表征。Folch实验室的另一项研究开发了一个96孔微流体平台,能够培养80个胶质母细胞瘤肿瘤切片或活检,并显示TMZ对GBM肿瘤的显著杀伤作用。两种微流体系统都显示出证据表明,微流体装置将提高肿瘤活检或组织切片的生理相关性和预测价值。然而,这些基于活检或组织切片的微流体装置仍需要进一步验证。
大多数实体肿瘤细胞系可在抗粘附条件下,在悬浮液中聚集生长形成球状,称为多细胞肿瘤球状体(MCTS)。MCTS已广泛用于药物筛选、肿瘤生长、增殖和免疫相互作用的研究。然而,MCTS比二维细胞培养更昂贵,操作更为复杂。传统上,MCTS是使用宏观技术(如超低附着板、基质、旋转瓶和悬滴培养)形成的。
最近,一些微流体技术已经被开发出来,通过在微孔或腔室结构中对细胞进行流体动力学捕获,可以产生大量大小一致的肿瘤球体,同时可以在芯片上进行多次复制。一些提供直接方法来释放和收集球体用于下游分析的设备也很有优势。然而,在一些微流控系统中产生的球体在芯片外的分析中是有问题的。
已经有许多微流体装置被设计用来改善球体周围微环境的控制。球体是用传统的宏观尺度技术制造出来的,然后放入微流体装置中。Amy Shen的实验室制造的微流体装置证明,在保持氧气的同时,可以通过改变葡萄糖水平来控制肿瘤球状体中的坏死核心,而不需要操纵球状体的大小。这种精确的控制在宏观系统中是不可能的。Chan实验室的另一个例子是单片肿瘤系统,将肿瘤球体添加到微流控通道中,可以实时分析纳米颗粒(NP)积累。这可能被用于研究化合物在生理流动条件下的渗透。目前所描述的设备适合于测试数十种化合物,而目前还没有HTS筛选。
基质和/或支架微流体模型由尝试在不加入血管成分的情况下创建三维肿瘤微环境的方法组成。然而,由于无血管模型缺乏血管结构,这限制了长期培养的灌注量,以及对基质/支架内细胞位置的控制不足,因此存在局限性。此类无血管基质/支架模型的例子包括使用双乳液中多个细胞聚集、水凝胶液滴、数字微流体平台、微流体和介电电泳的组合或相引导微流体通道的细胞生长/增殖测定。细胞迁移/侵袭模型也是无血管基质/支架模型的另一个例子。最近的一个例子表明,三维微流体模型可用于确定实体肿瘤试验中改变T细胞功能的因素(如炎症及氧水平)。这些免疫肿瘤模型可以作为临床前试验,以适合最有效的免疫治疗配置为特定的治疗目标。这些更复杂的模型非常适合测试数十种化合物的功效和MOA研究(图3)。
血管系统在肿瘤生物学中起着重要作用。对于癌症的生长和扩散,它需要一个不断增长的内皮网络提供的营养支持,而内皮网络也可以调节TME。传统的transwell实验在复制肿瘤血管生成和肿瘤-内皮细胞相互作用方面是不充分的,其中内皮细胞被放置在膜的上表面,靠近肿瘤细胞的下层。肿瘤血管系统的特征之一是由于内皮细胞的不连续而导致的渗漏,这在传统的体外方法中是无法复制的。肿瘤血管在转移级联如侵袭、内渗和外渗等几个关键步骤中起着关键作用。同样,肿瘤内的血管系统在再现免疫细胞浸润(即粘附或跨内皮迁移)方面也至关重要。
微流体系统创建了微血管网络,允许肿瘤血管系统、癌细胞和TME之间的复杂相互作用。微流体模型中包含的高分辨率延时成像是实时测量其动态的一个重要优势。快速发展的免疫肿瘤学领域将特别受益于这些更复杂的肿瘤模型,以在动物模型中无法轻易实现的方式更好地研究免疫-癌细胞的相互作用(图3)。
4.3 挑战与局限
微流控平台与大多数体外试验一样,用详细和可控的方式研究生物现象,但可能导致建立与生理学不相关的模型。固体肿瘤微流体模型的潜在挑战包括对临床肿瘤组织平台的验证、药物对临床验证的肿瘤化合物的反应性,以及模拟微环境日益复杂的情况,如化学浓度梯度和生物相关速率下的流体流动。此外,肿瘤微环境作为TME的精确再现是复杂的,其中的各个组成部分经常相互作用和影响。此类平台的设计和优化仍然面临着巨大的挑战,它们的稳定性、可再现性和可扩展性也是需要克服的主要障碍。