资讯信息
NEWS
资讯信息
NEWS
综述解读|复杂体外模型(CIVMs)在药物开发的安全性测试和疾病模型中的应用(上)
2023-01-15

1、引言:体外复杂模型的一般概念
随着人类平均寿命的延长,人们对医疗保健系统提出了更高的要求。虽然急需更多有效的药物和治疗方案,但处于减轻公共卫生系统负担的考虑,应制定更节约成本的策略。为了实现在正确的时间为患者提供恰当的预防和治疗,需要从药物开发的早期阶段开始就提高预测能力,做出更准确的决策。这种革命性的药物开发既需要识别新的生物标志物,也需要人源的实验工具来评估药物的有效性、安全性。
1.1 CIVM制药领域的曙光
在过去的十年中,我们见证了创新性的体外技术的诞生,这些技术已经被越来越多的科研机构和小企业使用。随着使用的激增,新的技术解决方案也以也来越快的速度出现。虽然,在动物疾病模型(如转基因小鼠)方面已经取得了巨大的进步,但这些疾病模型不足以模拟人类疾病的全貌。例如,在动物实验中观察到的毒理学结果,无法预测某些患者的毒性反应。从临床前到临床之间存在的这一鸿沟,一直是生物学家和工程师们研发新型复杂体外模型的动力。
1.2 复杂体外模型在研发中的预期作用
目前,在大多数治疗领域,新药审批的总体成功率仍然很低。依据12家大型制药公司提供的数据,一种新药获得上市批准的3年移动平均成本从2010年的12.22亿美元增长到2017年的17.3亿美元。
在导致新药研发失败的几个原因中,缺乏与人相关的模型被认为是药物研发第一阶段临床试验阶段失败的主要原因。尽管细胞模型在作为组织和器官替代物的方面取得了相当大的进展,但培养的细胞往往无法维持原有的特异性分化和表达。而动物模型往往无法可靠预测人类的测试结果。当下,创新性的人源复杂体外模型在个性化建模、生产量和预测能力等方面被认为有超越动物模型的优势。
制药行业期望通过实施更多与人类相关的体外药理学活动,以确保临床前期实验能顺利转化到临床,减少少2期损耗。而新的复杂体外模型提供了一种可以改变游戏规则的解决方案,使制药行业从一刀切的方法转向精准医疗。但现在就预测这些技术在未来5-10年可能产生的影响还为时过早。
1.3 复杂体外模型的全球市场
当前技术的全球市场规模和增长潜力的数据,有望预估这些技术在再生医学方面的快速扩展。根据BBC最近的一份研究报告,3D细胞培养的市场在2016年达到了10亿美元,到2021年应达39亿美元,从2016到2021年的复合增长率(CAGR)为42.6%。而3D打印作为一个细分市场,2016年达2.26亿美元,到2021年应达5.96亿美元,5年的复合增长率为21.4%。
1.4 更接近人体的疾病模型:当前的差距和挑战
在过去十年中,一些重要的技术空白已被填补。复杂结构中的多细胞混养、有能力给细胞施加生化和机械刺激、微流控组件使静态培养转换为可控的动态培养,以及使用集成分析设备来检测生化过程,这些都是为提高与人体的相似性而取得的一些进步。然而,即使是最新的3D复杂体外模型也与科学界的雄心壮志之间存在差距。这些差距将技术开发人员未来面临的挑战:
(1)缺乏整体性:当前的复杂体外模型不能模拟所有的组织和器官的特异性生理功能,而构建整体性模型是业界的最大野心之一。整体性模型不仅能够验证先前假设的机制和过程,同时可以对非靶向器官的反应和机制进行观察。同时,制药行业可以使用整体性模型这个平台,来满足不同用户的不同需求。
(2)缺乏综合生理学:在过去的5年里,产生了第一个基于微生理系统的人类多器官工程的原型。然而,通过小管简单连接构建的复杂体外模型,无法反映每个器官独特的血压和流速,还有多种动态成分(如:营养物质、pH值、细胞因子、代谢物、氧和氮气)。其次,目前的多器官原型仍然过于简单,无法再现器官内部和不同器官之间复杂的细胞通讯(如:介质、蛋白质、激素和电刺激)。而这些“对话”是病理生理过程的基础。
(3)缺乏代谢能力:代谢这个空白对毒理学研究的影响特别大,同时,代谢产生的活性分子具有触发次级药理学活动的作用。此外,从开发个性化药物的角度看,模型模拟 “好”或“坏”代谢产物的能力将特别关键。
(4)缺乏细胞防御机制:免疫系统在治疗多种疾病中起着关键的作用。想在体外获得治疗、肿瘤、免疫介导等过程得有效数据,所构建的系统必须包含关键的免疫元件。例如,在免疫肿瘤学中,监测T细胞迁移与肿瘤杀伤结合,将是个非常有价值的工作。
1.5 CIVM的标准
在开发整体模型之前,科学家需要一个评估复杂体外模型的标准。应该考虑到不同技术和领域的要素,制定严格的尽职调查清单。此外,如果业界能对标准达成共识,将有效的确保个研发领域和学科评估的一致性。
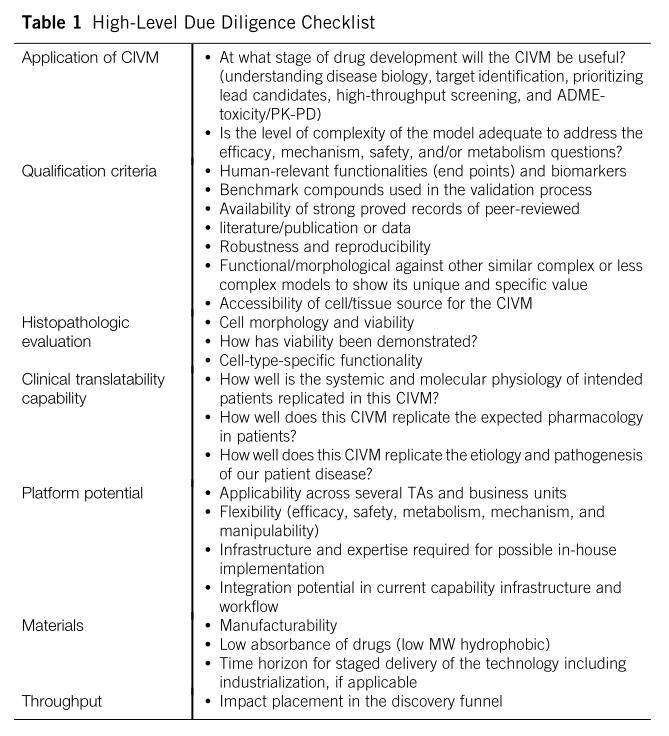
表1:高水平尽职调查清单
(表1给出了高级尽职调查的例子)由于需要基于模型所解决的特定生物学问题的能力进行评估,因此科学家需要制定尽可能多的调查清单(如表2)。
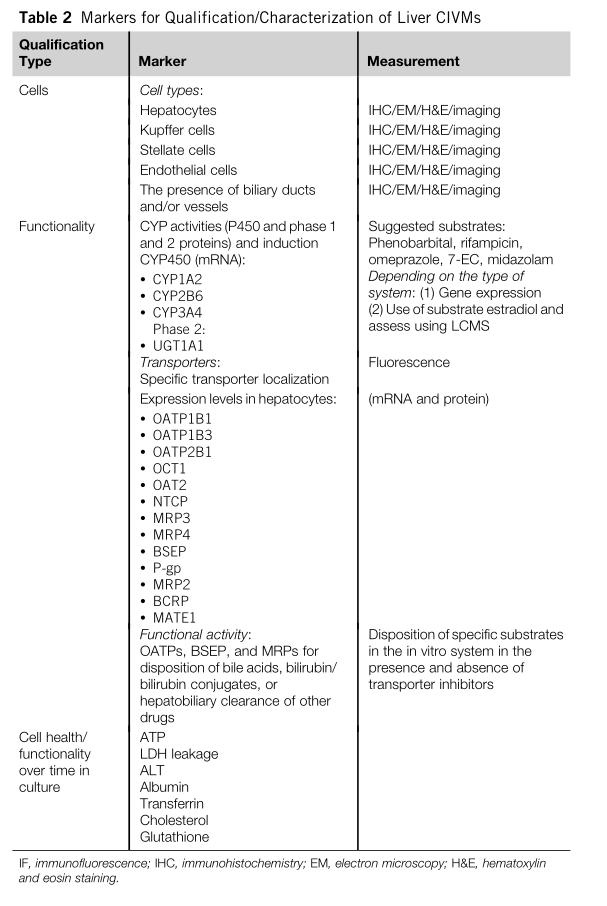
表2:不同肝脏体外复杂模型的引物
2、复杂体外肝脏模型
2.1 背景
肝脏是负责药物代谢和血液解毒的主要器官。药物不良反应(ADR)和药物诱导肝损伤(DILI)仍然是导致急性肝衰竭、药物研发项目的终止、临床前和临床期实验损耗以及上市后停药的主要原因。传统的原代人肝细胞和细胞系细胞2D培养已被广泛应用于肝毒物的毒性检测。然而,用这种方式预测新药效用的能力非常有限(由于ADR),尤其是无法获取多样、复杂的毒性机制。
细胞培养技术和新兴平台(即组织工程、微流体、微生物制造和生物打印)的最新进展表明,新的生理相关性的体外肝脏模型,有望提高预测药物肝毒性。正如Lauschke等人所述,理想的体外肝脏模型应具有药理学应用和安全性评估的共同特征,包括:
(1)细胞活力、细胞间相互作用和功能性(即氨代谢、白蛋白产生、免疫反应性、CYP450、转运蛋白和核受体表达)能够在培养物中稳定维持数周,以满足慢性毒性和疗效的研究;
(2)分子水平上的细胞表型和细胞与细胞的比率(即肝细胞和NPCs)能准确反映人类的实际情况;
(3)模型与体内原始形态(即胆管的存在)、生理微环境参数(即氧气压、梯度、营养物质交换和成带现象)之间的相似性;
(4)模型经一组毒性机制已知的肝毒物进行鉴定,其效果优于2D简单体外模型;
(5)高通量,适用于体积和细胞数量相对较低的复合筛选;
(6)具有重现性和成本效益。
我们常常认为技术是我们开发更多与人类相关的模型的主要限制,而实际的瓶颈或障碍来自于缺乏对生物过程复杂性的理解。由于传统的2D模型已在其他文献中得到了很好的覆盖和综述,本文中,我们将重点放在三维(3D)肝脏复合物体外模型及其在药物发现和开发中的潜在用途和局限性上。
2.2 肝脏模型
2.2.1 “三明治”培养模型
“三明治”培养模型可能是公认的最简单的 “伪”3D模型,这种方法可以维持肝细胞的极性和肝脏特异性功能,肝细胞在两层细胞外基质(ECM)成分(如胶原蛋白或基质胶)之间生长。原代人肝细胞(PHH)已被证实可以在其中稳定保持极性和形态长达2周,有研究表明,模型可用于研究药物诱导的肝毒性、药物间相互作用、肝胆运输和药物诱导的胆汁淤积性肝损伤的。然而,“三明治”培养模型的肝功能随时间逐渐降低,受ECM屏障限制导致的灵敏度低(即氧气,营养素和化合物的损害),ECM的批次间差异和稳定性有限等因素,限制了该模型的使用。
2.2.2 3D肝细胞球和多细胞球
为了延长培养期和保留肝细胞功能,研发人员广泛开展了单种细胞或多种细胞共培养的自组装3D聚集体的研究(所谓的球状体或也称为“球形微组织”)。 已经报道了使用各种细胞源(即,从肝细胞系到多细胞原代或干细胞来源细胞)及各种制备肝细胞球的方法(包括超低附着(ULA)表面上的简单培养到相对高通量的自动悬挂-下降系统培养等)。与单种肝细胞球体相比,由于细胞间的相互作用,多种细胞共培养的细胞球都表现出更增强的细胞功能和存活率。与2D培养相比,这些自组装球体,在细胞-细胞的接触、细胞的极化形态,胆小管、桥粒和紧密连接、参与合成的基因的代谢活性和表达的增强和转运体等方面更接近体内肝组织的各个方面。最近在一项在重复剂量长期治疗(长达14-28天)研究中,自组装的人类肝脏多细胞球状体使用110种上市药物(分别为DILI阳性和阴性)进行了测试,多细胞肝细胞球展现出更强的敏感性。然而,随着球体尺寸的变化,氧气和营养扩散有限,导致的坏死核心,以及相对较长的孵育时间,球体形成稳定性周期短(<28天)仍被认为是限制其在主流药物测试和开发中广泛使用的主要原因。
2.2.3 中空纤维生物反应器和器官芯片
由于3D培养的氧气和营养扩散有限,越来越多的研究尝试利用提供灌注系统去克服缺乏血管系统的限制。这包括基于动态流体的系统从较简单的小型中空纤维生物反应器到微流体多器官芯片(MOOC)不等。据几篇研究报道称,使用微尺度(~2 mL)生物反应器可增强实质和非实质细胞的生理结构以及肝细胞功能,例如白蛋白和尿素合成,CYP450活性,并将药物毒性测试的总培养时间延长至3周。然而,目前的设计仍无法实现生理流动梯度,以及有限的通量,这限制了该系统更广泛地用于药物开发中的毒性研究。
2.2.4 3D生物打印肝脏
3D生物打印是制作复杂的体外肝脏模型的方案之一。该方案的独特优势在于它能够在不同的位置打印不同的细胞类型,对细胞-细胞的简洁控制可以在创建的肝脏模型中看到分区、架构、肝细胞间微血管网络和紧密细胞间连接的形成。3D生物打印肝脏模型既能有效模拟药物诱导肝损伤,又能区分具有不同特征的化合物肝毒性(例如,有毒的曲伐沙星与无毒性的左氧氟沙星)。尽管前景广阔,但就像其他3D生物打印肝脏模型一样,这些3D生物打印肝脏模型也需要进一步的表征和更全面的验证,才能在药物开发中应用。
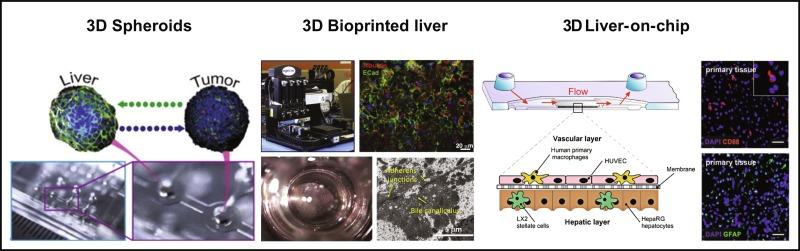
图:三维体外肝脏模型:分别为3D肝细胞球,生物打印肝脏和芯片肝
2.3 肝脏体外模型存在的局限性和挑战以及未来展望
在过去的20年里,人们在建立检测药物代谢和肝毒性的复杂体外肝脏模型中取得了巨大进展。然而,体外模型均一性差,受细胞类型、细胞来源、培养基浓度范围、细胞的生理状态和微环境等因素的影响,以及缺乏标准化、表征鉴定、验证标准,这可能是制药行业不使用这些模型解决的主要原因之一。同时,大多数复杂体外肝脏模型只与相应的简单2D肝脏模型进行了比较,而与人体真实肝脏代谢比较的数据较为缺乏,在人体相关性和临床可译性方面尚未得到充分的研究和证明。
许多专家提议,未来需要以最大限度地利用这些复杂的体外模型,明确与现有动物实验和临床数据之间的关系,也将需要一份精准全面的更接近人体和临床的体外检测清单。理想情况下体外复杂肝脏模型会在制药、生物技术、学术界和政府的联合下进行的大规模验证。通过整合不同平台的数据和工作,希望增加我们对药物靶点、治疗安全性和有效性、药物机制以及分子、细胞、组织和器官水平代谢的理解,进一步完善三维复杂体外肝脏模型来辅助决策,减少错误和药物损耗,并为患者发现新药。